科研進展
近日,精密測量院生物大分子動態學團隊與復雜生物體系波譜分析團隊合作,在G蛋白偶聯受體(GPCR)動態激活機制研究方面取得重要進展。研究團隊集成全原子分子動力學模擬和NMR技術,完整解析了毒蕈堿型乙酰膽堿受體(M2R)從非激活態向完全激活態轉變的動態過程,并揭示芳香環動力學在GPCR激活過程中的核心作用。相關研究成果近日發表在《美國國家科學院院刊》(PNAS)上。
GPCR作為人體最大的膜蛋白受體家族,是超過30%的已上市藥物和超過半數的在研藥物的作用靶點。盡管近年來冷凍電鏡等結構生物學技術解析了大量的GPCR結構。但是,GPCR如何通過動態構象變化實現信號傳遞,特別是各類激動劑如何精準調控受體構象的動態變化,不同配體效能差異的分子機制等關鍵科學問題始終沒有得到解決。
研究團隊采用分子動力學模擬技術,對M2R在激動劑/反向激動劑結合、納米抗體結合、G蛋白結合等不同功能狀態進行了系統性研究。通過累計超過100微秒的模擬數據,捕捉到受體激活過程中的兩個關鍵中間態:一是配體結合口袋在激動劑結合后發生收縮;二是芳香環的動態變化和傳導引發TM6螺旋部分打開。研究團隊發現W4006.48和F3966.44這兩個關鍵芳香族氨基酸的動態行為構成信號轉導的“分子開關”:W400與激動劑結合時通過側鏈旋轉形成穩定的堆積作用,而F396增強的動力學漲落則促進中間態向激活態轉變。M2R在結合不同配體時的動態行為也完美的解釋了液體核磁共振實驗中譜峰的化學位移變化。
該研究成果完整揭示了受體構象變化的時序/動態過程,突破了傳統“兩態模型(非激活/激活)”的理論框架,表明M2R激活存在多步驟動態路徑的重要特征。更重要的是發現不同配體的結合以動態變化的形式編碼儲存在芳香環的運動中。該發現為基于動力學的靶向藥物設計提供了全新視角。
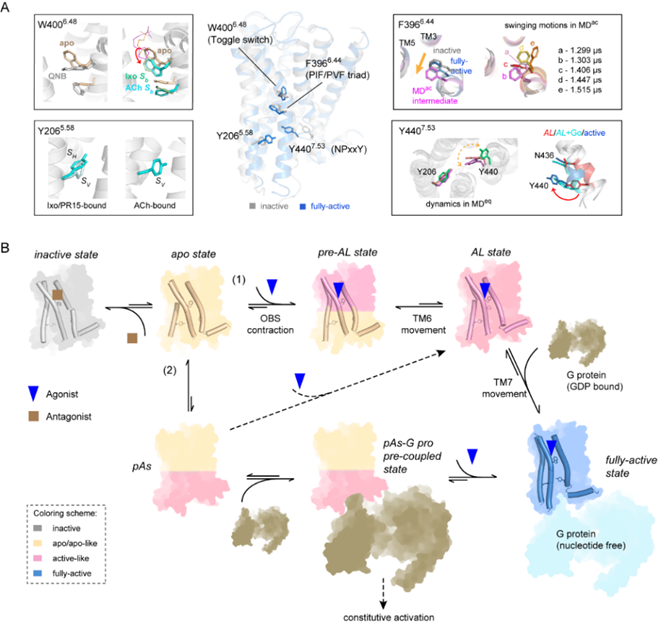
M2R的激活機制示意圖
相關研究以“Visualizing agonist-induced M2 receptor activation regulated by aromatic ring dynamics”為題發表在《美國國家科學院院刊》。精密測量院副研究員龔洲為該文章的第一作者和通訊作者,研究員胡蘊菲為共同通訊作者。
該項研究工作得到了中國科學院戰略性先導科技專項、中國科學院青促會、武漢市黃鶴英才計劃等項目的資助。
論文鏈接:https://www.pnas.org/doi/10.1073/pnas.2418559122

 新聞
新聞